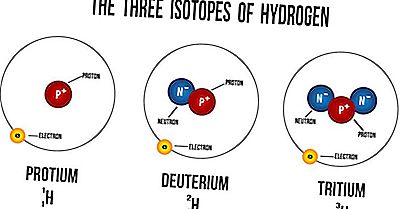
Cos'è un isotopo?
Gli isotopi sono atomi dello stesso elemento che hanno un numero uguale di protoni ma un diverso numero di neutroni. I loro numeri atomici sono gli stessi, ma i loro numeri di massa sono diversi. I numeri di massa sono sempre indicati con A, mentre Z si riferisce ai numeri atomici degli elementi. Il numero atomico simboleggia il numero di protoni nel nucleo di un atomo e viene utilizzato per identificare la posizione dell'elemento sulla tavola periodica. Il numero di massa di un atomo è il numero di neutroni nel suo nucleo. Gli isotopi degli elementi hanno proprietà fisiche diverse a causa della variazione delle loro masse atomiche. A causa di questa differenza, tali isotopi hanno densità diverse, nonché punti di fusione e di ebollizione. Tuttavia, gli isotopi di un elemento hanno sempre proprietà chimiche molto simili. La somiglianza si verifica perché solo gli elettroni sono utilizzati nelle reazioni chimiche, non nei neutroni o nei protoni.
Storia degli isotopi
Il radiochimico Fredrick Soddy ha suggerito per la prima volta l'esistenza di isotopi in 1913 dopo aver condotto studi che hanno coinvolto il decadimento di catene radioattive. Durante i suoi esperimenti, Soddy realizzò una quarantina di specie diverse tra piombo e uranio, tuttavia la tavola periodica poteva ospitare solo gli atomi 11. Dopo che i test chimici condotti per separare alcuni di questi elementi avevano fallito, suggerì che più di un tipo di atomo poteva condividere la stessa posizione nella tavola periodica e chiamarli isotopi.
Esempi di isotopi
Il cloro contiene due isotopi principali: cloro-35 e cloro-37. Per arrivare a questa conclusione, gli scienziati hanno scoperto che in una sostanza di cloro, le proporzioni di ciascuno di questi isotopi esistono nel loro complesso, ed è per questo che i rapporti vengono utilizzati per esprimere la differenza in termini di quantità. Questi rapporti sono utili quando si calcolano le percentuali relative e le masse atomiche relative. Altri esempi di isotopi includono carbonio (carbonio-12 e carbonio-14 isotopi), ossigeno (ossigeno-16 e ossigeno-18) e fosforo (fosforo-31 è l'isotopo primario, sebbene esistano anche quantità specifiche di fosforo-32). Gli isotopi di questi composti sono considerati stabili e la maggior parte di essi ha solo due isotopi. Tuttavia, ci sono alcuni elementi che hanno un solo isotopo, e questi includono fluoro, berillio, arsenico, ittrio, oro, alluminio, iodio, manganese, sodio e niobio.
Purificazione degli isotopi
Esistono tre aree principali in cui vengono applicati gli isotopi. Il primo è la separazione degli isotopi. La separazione facilita la massimizzazione delle proprietà degli atomi come richiesto. Nella separazione di elementi più leggeri come il deuterio e l'ossigeno, vi è l'applicazione del metodo di diffusione del gas. La separazione di elementi pesanti come l'uranio e il plutonio avviene mediante spettrometria di massa.
Applicazione degli isotopi
La prima applicazione degli isotopi è il suo uso da parte degli archeologi nella datazione al carbonio. Gli isotopi sono di due tipi: isotopi stabili e radioattivi. Gli isotopi stabili contengono la stessa combinazione di protoni e neutroni e come tali non subiscono il decadimento. D'altra parte, gli isotopi radioattivi hanno nuclei instabili e quindi subiscono decadimento. Il decadimento radioattivo può richiedere fino a 5,730 anni, come l'elemento carbonio. Gli archeologi usano questo componente degli isotopi per determinare l'età di un oggetto trovato negli scavi archeologici.








